成功の反対は失敗ではなく、何もしないこと:ウェビナー「新薬開発の道のり」レポート(2)
2020年11月21日(土)に開催した、アステラス製薬株式会社様にご協力いただいたウェビナー「新薬開発の道のり」レポート(2)です。後半は開発本部日本・アジア臨床開発第2部 大室信太郎様から「新薬の開発プロセス」のご講演をいただきました。

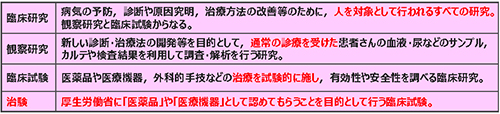
治験は安全第一で。参加は患者の自由意志で。
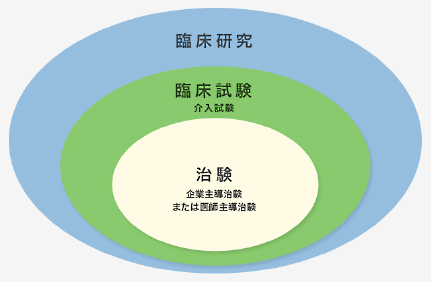
「臨床試験」とは、通常診療外での新薬開発など、治療を試験的に行い、その有効性や安全性を調べるものです。その中でも、医薬品として厚生労働省に認めてもらうことを目的に行うものを「治験」といいます。
臨床研究の中の治験の位置づけ
治験は下記の3つの段階に分けられます。
第1相試験:健康な人で ごく少量から少しずつ増やし、安全性を確認
第2相試験:少量の患者で 効果や安全性、効果的な使い方を調査
第3相試験:多くの患者で 第2相の結果が多くの患者で当てはまるか調査
治験が終了すると、データをまとめて、厚生労働省所管の医薬品医療機器総合機構(PMDA)に品質、有効性及び安全性の審査を申請します。この審査に通ってはじめて新薬が誕生します。なお、販売後も効果や安全性についての調査は続けられます。また、治験により集まったデータはウェブサイトで公開する流れが広がっています。
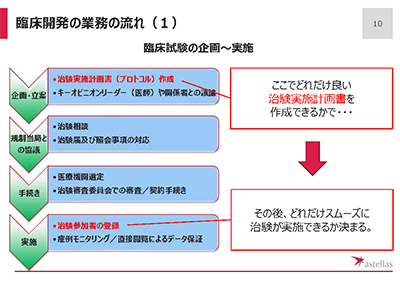
治験を進めるうえでは多くのプロセスがあり、おおまかな流れは以下のとおりです。
- 企画
どういう患者に治験に参加してもらうか、期間はどうするか、どういう項目を見るか、などの治験実施計画を立案 - 規制当局との調整
治験相談(科学的な妥当性の確認) - 手続き
治験実施医療機関の選定 - 実施
治験参加者の登録
PMDA、医療機関で承認された実施計画だけが治験参加者の登録に進めることができます。
ただし、治験は製薬企業が強制するものではなく、あくまで患者の自由意志による同意が必要です。患者への負担や不利益が大きい計画は登録が進まないため、良い実施計画であるほど、スムースに治験が実施できるといっても過言ではありません。
治験実施中において、患者の安全は非常に重要であるため、製薬企業は医療機関と連携し、情報収集します。もちろん得られたデータの正確性も重要な項目です。多くの人が関わり、治験が成功するように取り組んでいます。
治験実施の厳しい現実
アメリカでの調査結果によりますと、11%の病院で治験参加者が1名もおらず、37%の病院で参加者数が予定数を下回っていた、と報告されています。また、86%の治験が予定実施期間内に完了せず、なんと約20%の治験で、参加が進まないために途中で中止になった、という現実があります。せっかく基礎研究を進めて、治験実施計画を作成しても、このような状況ですと、治療薬を得る機会を逃すことにつながってしまいます。

患者会は、製薬企業と医療者をつなぐ架け橋に
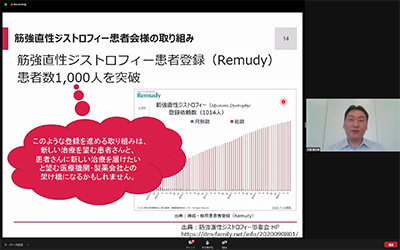
一方、当患者会が患者の立場から同じ患者に勧める「筋強直性ジストロフィー患者登録(Remudy)」で、登録患者数が1000名を超えており、素晴らしい、とお褒めの言葉を頂きました。このような登録を勧める取り組みは、新しい治療を望む患者と新しい治療を届けたい医療機関や製薬企業の架け橋になると期待される、とのことです。
条件付き承認制度は、“重篤な疾患”に対し“医療上の有用性が高い医薬品”を“早期に実用化(承認)する”制度
条件付き承認制度と呼ばれる制度があります。通常、治験には3つの段階がありますが、この制度は、一定の基準を満たしている医薬品について、検証的臨床試験の成績を求めることなく、市販後に必要な調査等を実施することを承認条件として製造販売承認を与えることで、その3つ目の段階(第3相試験、検証的臨床試験)が終了していない状況での早期実用化を可能にしています。適応される基準は以下の4点で、すべて当てはまる必要があります。
- 適応疾患が重篤であると認められること
(①生命に重大な影響がある疾患(致死的な疾患)であること、②病気の進行が不可逆的等で、日常生活に著しい影響を及ぼす疾患であること) - 既存の治療法等と比較して有効性又は安全性が医療上明らかに優れていると認められること
(①既存の治療法等がないこと、②有効性、安全性、肉体的・精神的な患者負担の観点から、医療上の有用性が既存の治療法等より優れていること) - 検証的臨床試験の実施が困難であるか、実施可能であっても患者数が少ないこと等により実施に相当の期間を要すると判断されること
- 検証的臨床試験以外の臨床試験の試験成績等により、一定の有効性、安全性が示されると判断されること
条件付き承認制度が適用された場合、承認条件として製造販売後の有効性・安全性の再確認のために必要な調査等の実施が必要となります。承認後に実施された調査等の評価を踏まえて、承認条件解除等の見直しが実施されます。
多くの患者が患者登録・継続をすることは、この点においても有効です。患者登録を継続することには大きな意義があります。
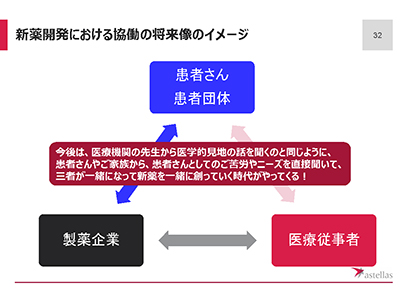
製薬企業と医療者、患者が協働し、本当に患者のためになる医療を
製薬企業は、患者と協働することで、治験の手順について患者の理解が進んだり、製薬企業との信頼獲得や患者の治験参加意欲の向上が進んだりすることを期待しています。
これまで国内の製薬企業は、直接患者からの意見を聞いたり対話したりする機会が少なく、多くの意見を医療者に聞いていました。
しかし現在は、医療者だけでなく患者とも協働をすることでよりよい成果につなげたいと考える企業が増えてきています。
治験への参加は、将来の患者に役立つことをしているという、社会貢献としての意義を実感してもらえることも大切です。
大室様は、チームのビジョンとして「成功の反対は失敗ではない。何もしないこと」と話されました。アステラス製薬様では、今後、患者を対象とする治験の実施計画作成において、患者からの声を治験の計画づくりのご参考にされる、とのことです。
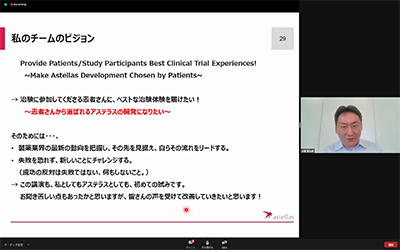
アステラス製薬様の姿勢からは、治験に参加する患者にベストな治験体験を届けたい!という思いを強く感じることが出来ました。
今後の創薬において、一般市民である患者と製薬企業・医療機関が互いに歩み寄り、理解しあいながら、ともに歩んでいくことで、研究成果を一日でも早く実用化し、患者や家族の元に治療薬を届けていただくことを期待します。
<最後に>
当患者会はアステラス・スターライトパートナー患者会助成に採択いただき、2018年にセミナー「体とこころのケア in 名古屋」を開催、2019年には「アステラス製薬 助成金報告会」で成果報告を行い、2020年2月に開発本部のみなさまに「筋強直性ジストロフィー」についてのご説明を行いました。
このとき、執行役員の田中茂樹様に、新薬を作るお仕事についてお伺いしたところ、「薬は、どんなに巨額の費用と長い時間をかけても、有効性と安全性がなければ製品にはならないのです」という話を伺いました。
病気を持つ患者と家族は苦しい日々を送っています。その解決のために思いもよらないような多大な苦労を製薬企業や研究者の皆様にかけているのではないか……そしてお話しの続きを聞かせていただきたいと、アステラス製薬様の講演をお願いいたしました。
終了後のアンケートからは、次のようなコメントが複数寄せられました。
- 製薬企業が患者の声に耳を傾けようと動き始め、これからはパートナーとしてやっていきたいという言葉がとても印象に残りました。
- 製薬会社さんとの対話会や研究者との意見交換会のようなことが出来たらよいと思います。
- ふわっとしか分かっていなかった新薬開発のプロセスでしたが、理解が深まった、非常に有意義な時間だったと感じています。
そして、アステラス製薬様に、多くのお礼の声が集まりました。
本ウェビナー開催にあたって、貴重な機会をくださったアステラス製薬のみなさまに、あらためて感謝を申し上げます。