病気の原因、遺伝子を治すために。さまざまな研究と治療薬開発が進んでいる!:ウェビナー「わかる遺伝子とゲノム編集」レポート
2023年10月15日(日)、ウェビナー「わかる遺伝子とゲノム編集」をオンラインで開催し、161人が参加しました。
写真は左上から反時計回りに、株式会社モダリス 森田晴彦様、京都大学iPS細胞研究所 掘田秋津先生、山口大学大学院 中森雅之先生、筋強直性ジストロフィー患者会 妹尾みどり
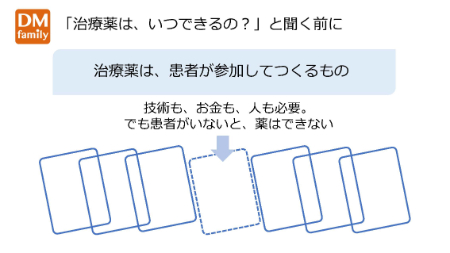
患者が参加しなければ、治療薬はできない
遺伝子がわからないと、治療薬もわからない
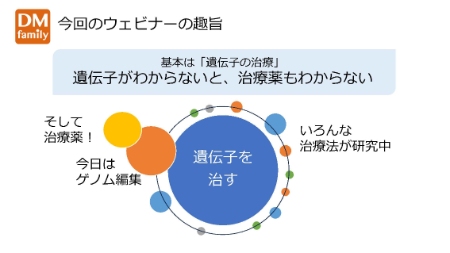
冒頭に筋強直性ジストロフィー患者会の妹尾みどり事務局長から、本ウェビナーの趣旨について説明しました。
ご存知の通り、筋強直性ジストロフィーの原因は遺伝子にあり、遺伝子に目を向けた治療が根本的な治療法になります。したがって遺伝子のことがわからないと、治療薬のことが理解できません。
今回のウェビナーでは「ゲノム編集」を含め、遺伝子から治療戦略まで、専門の先生からわかりやすく最先端の情報をご説明いただくこととしました。
患者が参加しなければ治療薬はできない
最初に、患者が臨床試験(治験)に参加しなければ薬はできないということを再認識しましょう。
治療薬は、技術力はもちろん、巨額の資金、さまざまな人々が協力して開発されていますが、患者が治験に参加しなければ薬にはなりません。
遺伝子や治療法のことが理解できない状態で、治験に参加することを決められるでしょうか?不安もあると思います。しかし治験への参加は患者自身が決めることです。患者が医師を気遣って参加したり、医師や家族、誰かが参加を強要したりするものではありません。
遺伝子や治療法のことについて知っておけば、「その時」が来た時、判断の手助けになると考え、今回のウェビナーを企画いたしました。
レポートはすべてを記載すると膨大になるために要約しますが、今後、同様のウェビナーを開催する場合には、ぜひライブでご参加ください。
わかる遺伝子と治療薬

中森先生からは、生物学の基礎から始まり、筋強直性ジストロフィー1型(以下、筋強直性ジストロフィー)の遺伝子変化、それに対する治療戦略、新薬開発から治験・製造販売までの流れ、現在行われている治験について、説明いただきました。
遺伝子の基礎知識
これまでのウェビナーでもたびたび説明されているDNA、遺伝子については、文章だけではく、図を見てもらったほうが分かりやすいかもしれません。
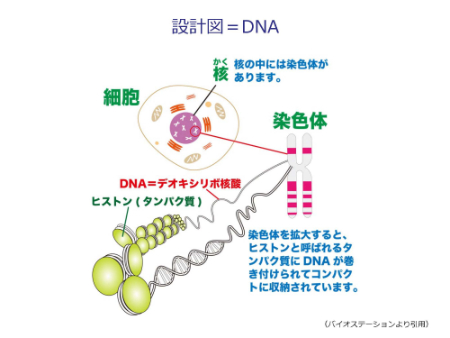
DNA(デオキシリボ核酸)は生命の設計図です。一つの細胞の中の核に、染色体という形で納められています。DNAを詳しく見ると、A(アデニン)、G(グアニン)、T(チミン)、C(シトシン)という文字(塩基)で構成されています。ヒトのDNAは30億の「文字」で構成され、その中に約2万個の遺伝子が刻まれています。遺伝子を刻んだ設計図であるDNAから、RNAに変換(転写といいます)し、RNAをもとにタンパク質を作る(翻訳といいます)、という流れでからだの構成成分が作られます。
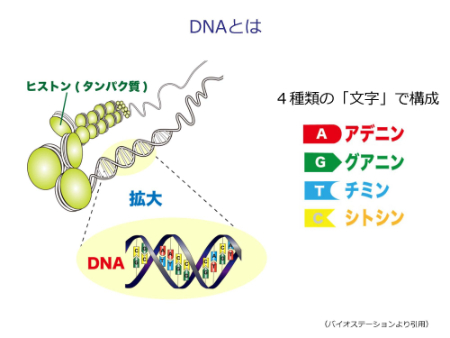
遺伝子についてもう少し細かく紐解くと、一つの遺伝子には遺伝情報がある部分(エクソンといいます)、が存在しています。DNAからRNAに写し取る(転写する)際に、エクソンを繋いで伝達RNA(mRNA)(設計図のコピー)になります。設計図コピーをもとにタンパク質が作れられます(翻訳されます)。以上が基礎知識です。

筋強直性ジストロフィーの原因は
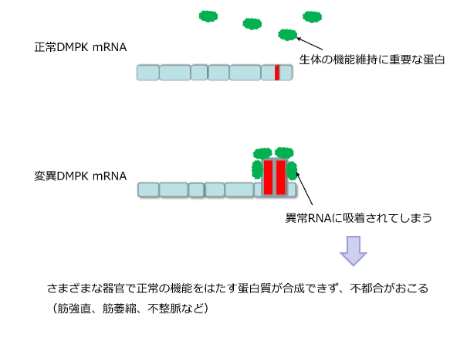
ここからは筋強直性ジストロフィーの遺伝子の異常についてです。図のように、筋強直性ジストロフィーの原因になるDMPKという遺伝子が存在します。
正常なDMPK遺伝子では、右端のエクソンにCTGの繰り返しが存在していますが、その繰り返しの数は正常では35回以下であり、正常なDMPKのmRNAが転写されるため、病気にはなりません。
病気になってしまう場合は、DMPK遺伝子のこの繰り返しの数に異常をきたし、50回以上の繰り返しになると、変異DMPK mRNAができてしまい、図の赤のような形(ヘアピン構造)になってしまうのです。
そして、緑で示す生体の機能維持に重要なタンパク質(MBNL1)が、赤で示す異常な部位に吸着されてしまい、正常な働きができなくなってしまいます。このタンパク質が働けないと、さまざまな器官で正常なタンパク質が合成できなくなるために、筋強直性ジストロフィーではさまざまな合併症(筋強直、筋萎縮、不整脈など)が起き得ます。
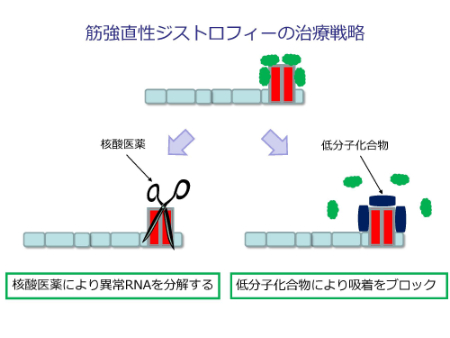
筋強直性ジストロフィーの治療戦略
上記がわかると、治療戦略が理解できることになります。
異常な繰り返しを分解する(核酸医薬)、吸着をブロックする(低分子化合物)などの方法が考えられます。
治療を実現するために必要なこと
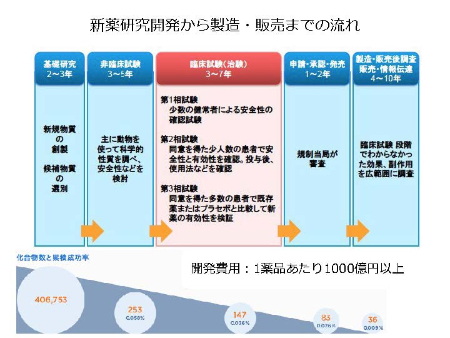
治療戦略はわかりました。では、それを実現するために何が必要でしょうか。さまざまな工程、資金、患者の協力などが必要です。
一般に、図に示すように、基礎研究に2〜3年、非臨床試験に3〜5年、臨床試験(治験)に3〜7年、申請・承認・発売に1〜2年、製造・販売後調査、販売・情報伝達に4〜10年とされます。開発費用は1薬品あたり1000億円以上といわれます。また、新薬の種から実際に販売される確率は0.009%といわれています。遠い道で、多くの研究者、開発者、医療関係者、患者、行政などが関わります。現在、当たり前のように服用しているすべての薬が、このような大変な過程を経て市販されているのです。
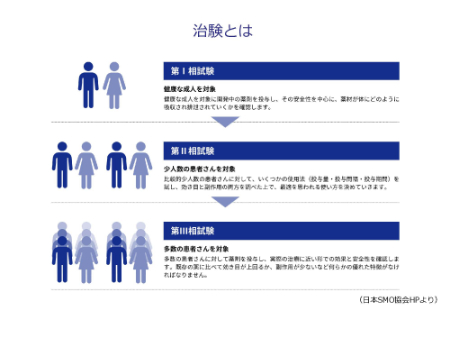
治験について、もう少しくわしく説明します。図のように、第1相試験、第2相試験、第3相試験があります。
筋強直性ジストロフィーの治療薬開発は、どこまで進んでいるか
薬の開発まで分かったところで、実際の筋強直性ジストロフィーに対する治療薬開発がどこまで進んでいるか説明します。
核酸医薬の改良
IONIS社が開発した核酸医薬IONIS-DMPKRX2.5は非臨床試験で良好な結果が出ましたが、2017年の第2相治験で、ヒトでは筋肉への移行が少なく有効性に乏しいという結果となり、治験は終了となってしまいました。
この結果から、どのように筋細胞に治療薬を到達させるかが課題であるとわかり、各社が開発を進めています。
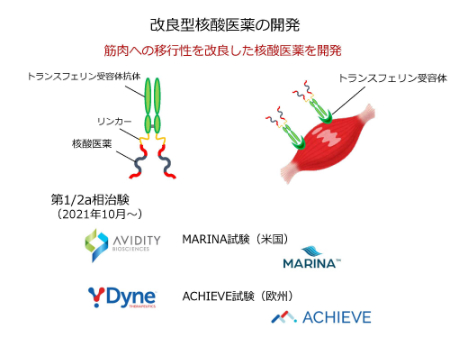
このうち、筋細胞に存在するトランスフェリン受容体に着目し、筋肉への移行性を改良した核酸医薬をAVIDITY BIOSCIENCES社、Dyne Therapeutics社がそれぞれ開発、治験第1/2相を開始しています。それぞれ、MARINA試験、ACHIEVE試験と名付けられています。
低分子化合物による筋強直性ジストロフィーの治療
また、低分子化合物を用いた筋強直性ジストロフィー治療研究では、さまざまな低分子化合物で基礎研究では有効性が確かめられてきました。
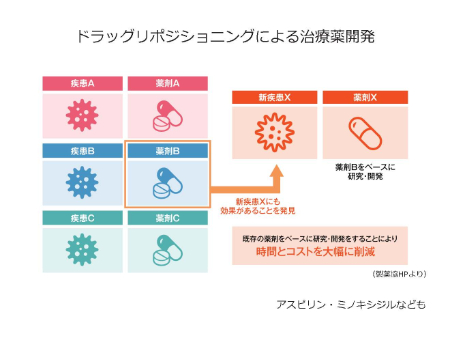
ドラッグリポジショニング(すでに他の疾患で使用されている薬剤であれば第1相の安全性試験を飛ばし、第2相試験から治験を開始できる)という、早く患者へ治療薬を届けることが可能になりうる手法があります。これにより時間とコストを大幅に削減することが可能となり、実際に、例えば、アスピリンやミノキシジルなども、元々の対象疾患とは異なる疾患にも効果があることがわかり、ドラッグリポジショニングで他疾患において使用されている例が存在します。
中森先生らは、筋強直性ジストロフィーのドラッグリポジショニング戦略として、抗菌薬として広く使用されているエリスロマイシンに筋強直性ジストロフィーモデルマウスの症状改善効果があることを見出されました。
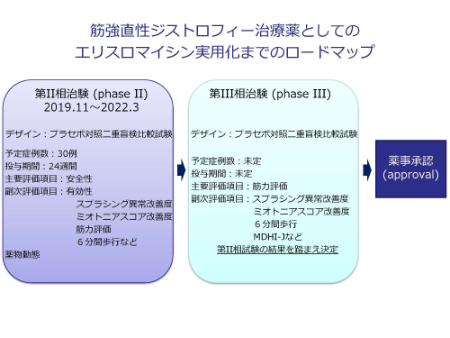
すでに安全性が確立しているため、2019年から、国内でエリスロマイシンを筋強直性ジストロフィー患者に投与する第2相治験が行われました。
講演後、治験第2相の結果が発表。
世界初の筋強直性ジストロフィー治療薬となるか
講演の時点で解析中でしたが、2023年12月27日、中森先生より、筋強直性ジストロフィーの治療薬として研究中の既存薬「エリスロマイシン」について、治験第2相の結果が発表されました。
筋強直性ジストロフィー患者30名に約半年投与した結果、主要評価項目である安全性については重大な副作用が起きないことを確認。また、有効性については、スプライシング異常がエリスロマイシン投与群で統計学的有意に改善していることが示され、筋障害の指標となるクレアチンキナーゼ(CK)値も、低く抑えられる傾向が見られたとのことです。
今後の第3相治験でより多くの患者に対するエリスロマイシンの安全性と有効性が実証されれば、世界初の筋強直性ジストロフィー治療薬としての薬事承認につながることが期待されます。
発表の詳細は山口大学ウェブサイトからご覧いただけます。
https://www.yamaguchi-u.ac.jp/weekly/27805/index.html
【ご注意】治験ではなく、適応外使用で服用することはやめてください。
今回の講演ではエリスロマイシンの治験のロードマップは下記のようになると説明がありました。
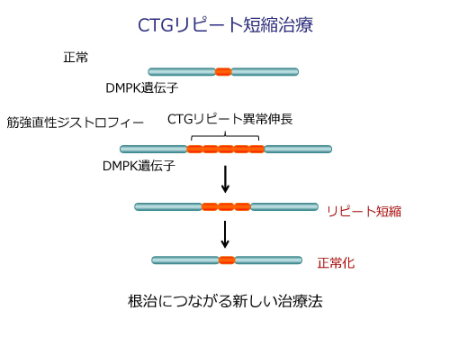
また、講演の最後には、ほかの治療戦略として、「CTGリピート短縮治療」という方法も考えられていると説明がありました。
中森先生率いる山口大学の脳神経内科ではこの病気の研究が精力的に行われており、その進展が期待されます。
ゲノム編集とは何か

誰もが平均20程度の疾患変異がある。「健康」はむしろ偶然
堀田先生からは、ゲノム編集技術(CRISPR:クリスパー)を中心としたご講演をいただきました。
ゲノムとは、DNAのすべての遺伝情報を指します。多様性と柔軟性があり、例えば他人同士で数百万文字(塩基)が異なります。
そして、疾患変異の観点からは、誰もが平均20程度の疾患変異を保有しているとされ、「健康」はむしろ偶然ということもでき、発症者は社会全体で支える必要があるといえます。
とりわけ、原因不明・治療法なし・希少疾患・長期療養が必要とされる、指定難病333疾患のうち56%は遺伝子変異が原因とわかっています。そこで、遺伝子変異を直す新規治療法が必要とされています。
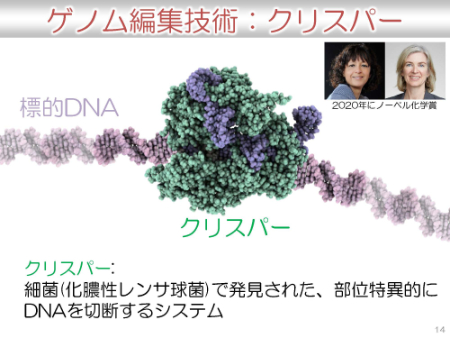
ゲノム編集技術、クリスパーとは?
クリスパーは、細菌から発見された、部位特異的に(望む位置に)DNAを切断するシステムです。2mのDNAの中から0.001μmの領域を狙って削除が可能と言われています。故に、ゲノム編集はDNAのハサミという例えがされます。
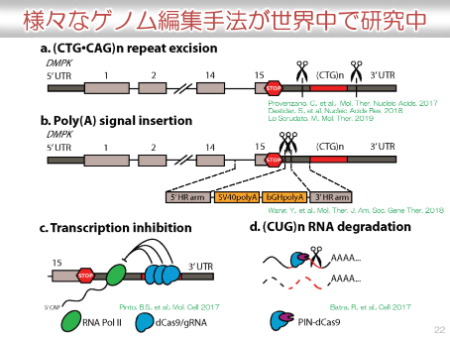
私たちの病気である筋強直性ジストロフィーでは、DMPKのCTGの異常な繰り返しが原因でした。その部分を選択的に削除できれば、根本的な原因を除去できると考えられます。(下図a)
その他にもCTGリピートの前に転写を止めるためのPoly(A)シグナルをいれること(下図b)や、切る能力を無効化させたCas9とガイドRNAの複合体でCTGリピートの部位が作られるのを防ぐこと(下図c)などさまざまなゲノム編集手法が世界中で研究中です。
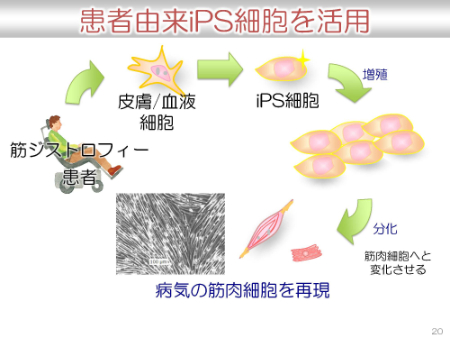
iPS細胞と治療法開発
京都大学iPS細胞研究所では、患者由来のiPS細胞を活用した研究が行われています。患者から細胞をもらい、iPS細胞に分化させ、増殖させ、さらに、必要な細胞へ分化させ、病気の細胞・組織を再現することが可能となっています。
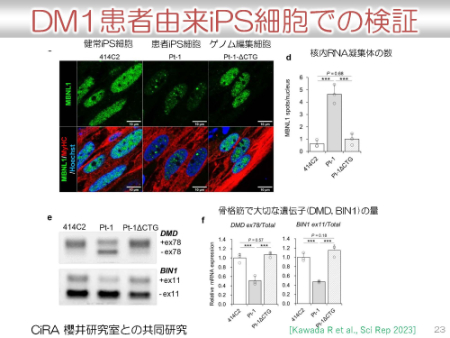
以下は、筋強直性ジストロフィー患者由来iPS細胞で検証されたデータの一部です。中森先生の講義を復習すると、変異している遺伝子DMPK の繰り返し部分のmRNAがヘアピン構造によって生体の機能維持に重要なタンパク質(MBNL1という転写制御タンパク質)が吸着されてしまい、正常な働きができなくなってしまうということが、筋強直性ジストロフィーの主要な病態メカニズムでした。
患者由来iPS細胞においては、緑で染められたタンパク質MBNL1が凝集して点のようになっていることが示されています(上段の左から2番目)。
それが、ゲノム編集によって、正常のように改善して核内全体に広がっていることが示されています(上段の左から3番目)。
また、核内のRNA凝集体の改善や、骨格筋で大切な遺伝子のスプライシングの改善もグラフで示されています。
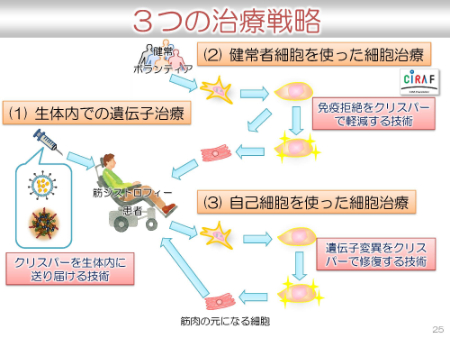
クリスパーを使った治療法には、主に下記3点です。
(1)生体内での遺伝子治療
(2)健常患者細胞を使った細胞治療
(3)自己細胞を使った細胞治療
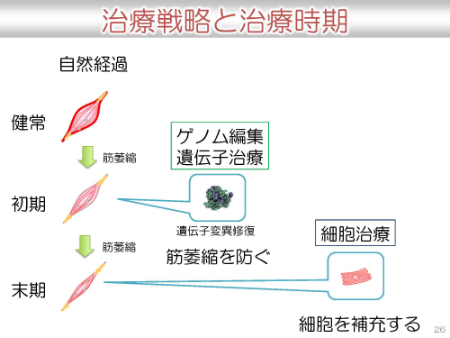
治療の選択には、治療する時期も関係します。
ゲノム編集による治療の課題
ゲノム編集が実際の治療まで届くには簡単ではなく、様々な課題も存在します。
・ゲノム編集の認識特異性は高いが、100%ではない。また、一度間違って改変してしまったDNAは元に戻せない。→安全性をしっかり確認することが必要。
・巨大なゲノムの中で、改変できるのはごく一部。→DNA修復方法を細胞や動物モデルで検証中。
・標的の骨格筋へ如何に届けるかが最大の課題。→無毒化したウイルスや他の伝達方法が開発中。
・遺伝子治療がそれほど一般化していない。→「産患学官民」それぞれの理解と努力が必要
(私たち患者も今回のようなセミナーで理解できるよう努めましょう)
最後に、「iPS細胞と遺伝子工学で不可能への挑戦」という言葉が、掘田先生から送られました。この言葉の裏には、堀田先生をはじめとする世界中の研究者や企業、行政、患者・家族の多大な努力が存在しています。
*CRISPR(クリスパー)とは
Clustered Regularly Interspaced Short Palindromic Repeatsの略で、原核生物でファージやプラスミドに対する獲得免疫機構として機能していることが判明したDNA領域のこと。
Casとは、CRISPR-Associated Proteinのことで、DNAを切断する機能を持つ酵素。
DMPK遺伝子をまるごとオフにする、
エピゲノム編集とは?
「エピゲノム編集(転写制御)による治療〜当社のアプローチと遺伝子治療を製薬の開発側の観点から〜」として、株式会社モダリス代表取締役CEO 森田晴彦様からご講演いただきました。

株式会社モダリスは、2016年に設立したCRISPRによるエピゲノム編集薬開発を世界で最初に始めた希少疾患に特化した製薬企業で、東京と米国マサチューセッツ州ウォルサムに拠点があります。
エピゲノムとは何か
エピは「の上」という意味で、エピゲノムとは、ゲノムの暗号配列を超えた存在といえます。
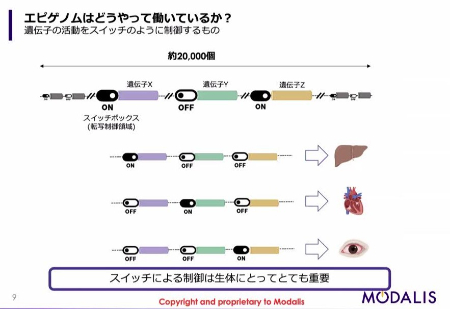
ゲノムには、約2万個の遺伝子がコードされて(生物を構成するためのタンパク質の情報が書かれて)います。
遺伝子のそれぞれには「スイッチボックス」のようなものがついていて、どの遺伝子がどの場所でどのタイミングでオンになるかということが、かなり厳密に制御されています。
例えば肝臓の細胞においては肝臓に特徴的な遺伝子がオンになっている一方で、心臓においては心臓に特徴的な遺伝子がオンになっている、あるいは目では目に特徴的な遺伝子がオンになっていて、他の遺伝子はオフになっている。これは生体にとって重要な制御となっています。これをエピゲノムによる制御といいます。
どのようにエピゲノム編集を治療に使うのか
遺伝子の制御が異常で病気になることがあり、例えば、ある遺伝子が発現しすぎて起っている病気に対しては、その遺伝子のスイッチをオフにしてあげる、あるいは間違ってオフになっていて病気になっているものに対しては、それをオンにしてあげる。
そうして、きちんと元通りにさせることで病気を治せるのではないかということが、エピゲノム編集による治療の基本的なコンセプトになっています。
CRISPR-Cas9は位置情報を決めるガイドRNAというものと一緒に結合しており、特定の場所に来て、そこでDNAの二重差を切断します。
そこで、Cas9の切断活性をわざと潰しておいて、代わりにこの遺伝子のスイッチをいじる転写制御因子というものを連結しています。
ガイドRNAによって目的遺伝子の位置に転写制御因子が連れてこられる結果、狙った遺伝子だけピンポイントでオンにしたりオフにしたりすることによって、この治療法が実現できるということになります(図参照)。
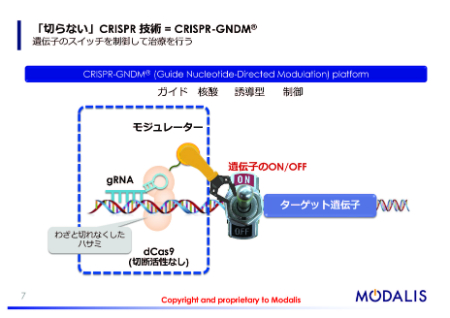
CRISPR-GNDM®プラットフォーム
モダリスではこれをGuide Nucleotide-Directed Modulation(ガイド核酸誘導型制御)プラットフォーム、「CRISPR-GNDM®プラットフォーム」としています。
遺伝子を切ったり、削ったりしないため、遺伝子を書き換えずに、そのスイッチの制御だけで治療を実現できるというところがエピゲノム編集の大きなポイントになっています。
また、ガイドRNAを変えるだけで、他の疾患にも応用できることがこのプラットフォームの魅力になっています。
目的の細胞に効率よく治療薬を届けるために
GNDMを目的の細胞に送り届けるために、組織特異的な(目的に合った)AAVウイルスベクターを使用します。
AAVウイルスベクターは、もともと天然にあったウイルスを使った汎用ベクターとして、過去には、さまざまな疾患の遺伝子治療に使われていました。しかし目的以外の肝臓などにも取り込まれてしまい、それを避けるために治療薬の用量が決まってしまう、という欠点があります。そこで対象臓器専用のベクターを開発し、目的の細胞に効率よく治療薬を届け、かつ肝臓など毒性の出やすい臓器に送達されないような工夫をしています。
CRISPR-GNDM®技術による筋強直性ジストロフィーの治療法
モダリスではエピゲノム編集を使って、メロシン欠損型先天性筋ジストロフィー(LAMA2-CMD)で開発が先行しており、筋強直性ジストロフィーやデュシェンヌ型筋ジストロフィーに対する取り組みも行われています。
筋強直性ジストロフィーの場合にはDMPK遺伝子のCTGリピートが原因になって発症するため、このリピートが(mRNAとして)出ないようにしてあげる必要があります。
そこで、GNDM分子をターゲットのDMPK遺伝子のスイッチ領域にデザインすることによって、この遺伝子がCTGリピートごと発現抑制できるようにデザインをされています。動物において、スプライシングが元通りになるということが証明できている状況にあります。
ではDMPK遺伝子をCTGリピートごと全部スイッチオフしてしまったら何か問題が出ないのかということについて、少なくとも病態モデルマウスや正常モデルマウスにおいてはこの遺伝子自体はシャットダウンしても問題ないということが確認されています。
つまり、この遺伝子ごとシャットダウンするという方法で安全性が担保された上で、筋強直性ジストロフィーの治療が可能となると考えられています。
多くの病気に治療を
モダリス社ではCRISPR-GNDM®プラットフォームによって、メロシン欠損型先天性筋ジストロフィー、筋強直性ジストロフィーだけでなく、デュシェンヌ型筋ジストロフィー、顔面肩甲上腕型筋ジストロフィーなどの筋疾患や、中枢神経障害、心筋症など患者が治療を待ち望む領域に注力する予定です。
「モダリスのメンバーは、40人で、みんな1日も早く治療を実現したいと願って真剣に開発を行っています。みなさんからの応援を引き続きお願いしたいです」と森田さまからのお言葉をいただきました。
最後に
「この病気はなぜ起きるのか?」という疑問。それを起点として、さまざまな努力が繰り広げられている治療薬研究の世界を垣間見るウェビナーとなりました。
お忙しい中でご講演をお引き受けいただいた講師のみなさまに、あらためて感謝申し上げます。