患者の協力なくして、新薬の開発なし!?:ウェビナー「希少疾患・難病の新薬開発を進めるために」レポート
2021年9月12日(日)、昨年度に引き続き、アステラス製薬株式会社様のご協力により、ウェビナー「希少疾患・難病の新薬開発を進めるために」を開催致しました。前回開催時のほぼ倍となる142名もの参加者が聴講しました。

未来を変えるため、勇気を持って行動しよう
開催に先立ち、世界の患者会が協働し、9月15日を「国際筋強直性ジストロフィー啓発の日」として制定したことについて、当患者会の妹尾みどり事務局長から説明を行いました。
なぜ、このように国際協調を行うのか?
それは、ひとつひとつの国における患者の数は少ないかもしれませんが、世界全体では多くの患者がおり、この病気の未来を変えるために、世界中から「治りたい」という声をあげることが大切だからです。
この啓発の日において、世界で様々なイベントが企画されました。アメリカでは多くの患者と家族が上院議会でこの日を記念日として認めてもらう活動を行っており、イギリスでは家族と患者が国内の名所のライトアップするよう交渉を行いました。
日本では、製薬会社と患者会が連携し、当セミナーを開催しています。
海外の患者は一般市民に対して、この病気の大変さを説明し、希望が欲しいということを広めています。それには、次に示すような「各国の当たり前」が欠かせません。
○病名を正しい名前で伝える
「筋ジス」は正しい病名ではなく総称です。筋ジス、だけでは正しく伝わりません。「筋強直性ジストロフィー」と伝え、自身の病気を広く知ってもらうことが、この病気の未来を変えること、将来の希望につながります。
○自分や家族の病気を、自ら伝える
自身や家族の病名を、人に知らせることは勇気が要ることかもしれません。でも、きっと大丈夫です。自らがしっかりと伝えることで、誰かが手を差し伸べてくれます。
○自分を大切に
不安だけを持たず、正しい知識を持ちましょう。日本には国民皆保険制度があり、医療が受けやすい国です。合併症が多いこの病気のケアには日頃の検診が大切です。
啓発の日は始まったばかりです。世界中の患者、家族、一般市民、医師、製薬企業の方々と共に、この病気の未来を変えていきましょう。

啓発の日制定を記念し、22カ国が参加したコンテストで選定されたロゴ
※作者はカナダの20歳の筋強直性ジストロフィー患者で、父親も兄弟も同じ病気を持っています。
新薬開発の情報は「言わない」のではなく、「言えない」
開発本部開発推進部 福永正浩様からは、本セミナー開催にあたってのご挨拶に続き、「新薬開発に関するルールとは」と題し、ご講演いただきました。
なぜ、日本では製薬メーカーの治験の情報提供について制限があるのか?
それはズバリ、日本の法律で規制されているからです。医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)により、承認もしくは認証を受けていない医薬品について、各種情報を宣伝してはいけない、とされています。
つまり、治験情報をセミナー等で話すことは、違法行為となる可能性があります。
では、どのようにすれば治験情報を得ることができるのか?以下に参考なるサイトを示します。
- 各製薬メーカーのホームページ
- 国立保健医療科学院の臨床研究情報ポータルサイト (日本における臨床研究が登録されているシステムを統合しているサイト)
https://rctportal.niph.go.jp/
- ClinicalTrials.gov (米国の国立衛生研究所が管理する世界最大のWeb型情報データベース)
https://clinicaltrials.gov/
続いて、ペイシェント・セントリシティ室 東山浩之様から「新薬開発の道のりと研究への患者・市民参画(PPI)」と題し、ご講演いただきました。
新薬開発の大まかな流れを理解しよう
薬はどのようにして生まれるのか?その道のりは大きく「研究段階」と「開発段階」に分けられます。これら2つの期間を合わせると、おおよそ9~16年といわれています。治験に長い時間がかかるイメージがありますが、実は研究段階にも長い時間を要します。
研究段階:細胞や動物を使って、薬の候補物質を探す段階(基礎研究、非臨床試験)
開発段階:人に投与し、効果や安全性を確かめる段階(臨床試験)
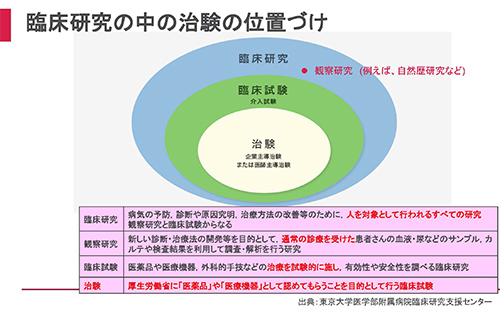
「臨床試験」とは、通常診療外での新薬開発など、治療を試験的に行い、その有効性や安全性を調べるものであり、その中でも、医薬品として厚生労働省に認めてもらうことを目的に行うものを「治験」といいます。また、臨床研究の中でも介入試験(臨床試験)ではないものは「観察研究」と呼ばれ、代表的なものに自然歴研究があります。
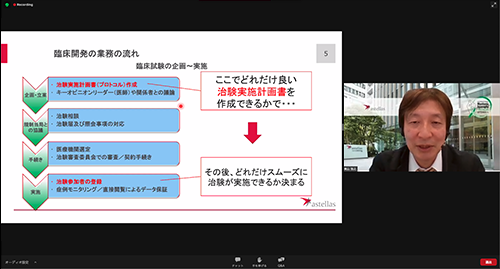
治験を進めるうえでさまざまなプロセスがありますが、重要なものとして、治験実施計画書(プロトコル、といいます)の作成があります。妥当な計画書を作成することで、よりスムーズに治験が実施できます。この計画をたてる段階で、対象疾患について、どれほど確実なデータを持っているかが重要となります。
観察研究による情報は、治療法開発への突破口
希少疾患・難病における開発計画の課題は、主に以下のものがあります。
- 患者数が少なく、十分な量のデータがない
【対処】国際共同治験や患者レジストリ(=患者登録:所在地、人数、症状、治療状況など)の充実
- 原因や病態の理解が十分でない
病気の原因がわからない、体の中で何が起こっているのか良くわかっていないために、治療薬の効果を評価しにくい
【対処】観察研究の実施、および、バイオマーカーの活用
- 病気の進行様式が十分にわかっていない
病気の進行の仕方が良くわかっていないため、治療薬の評価期間やタイミングがわからない
【対処】観察研究の実施
観察研究のデータを活用した医薬品開発を進めるうえで、確かなデータを得ることが重要になります。
医薬品開発のキーポイント「バイオマーカー」
治験を進めるうえで、疾患の状態を高い確度で知るために、バイオマーカーを用いる検討がなされています。バイオマーカーとは、血液、尿、唾液等からタンパクや遺伝子などの変化を調べて、疾患の状態を知ることができる指標のことです。例えば、血糖値やコレステロール値は生活習慣病のバイオマーカーです。このように確度が高く、患者への負担の小さいバイオマーカーがあると、その疾患を正確に診断できたり、病気の状態を正確に判断できたりする可能性が高くなります。
医薬品開発においても、バイオマーカーは大切であり、疾患の診断や医薬品が治療効果を発揮しているかを確認したり、安全性や毒性の評価をしたりすることに用いることができます。
このようなバイオマーカーを観察研究の中で見つけることは非常に重要であり、臨床試験が出来るかどうか、また、確度をあげられるかに直結しているため、研究が盛んに行われています。これは患者の協力が不可欠であり、患者の力で医薬品を創る、とさえ言えます。
もはや「患者の協力なくして、治療薬の開発はなし」
治験を実施するために、また、治験の成功確率を上げるために、観察研究やバイオマーカー研究が必要となります。そのためには患者の研究参画が必要です。
これまでの治験は、患者の単なる参加でしたが、これからは、患者の声や意見を取り入れる参画型の医薬品開発が行われます。現代の医薬品開発は、製薬メーカーや医師、行政だけではできません。患者自身が、理解、賛同し、市民参画されることが求められる時代になっています。
続いて、開発本部 日本・アジア臨床開発第2部 河西勇太様から「自然歴研究と患者報告アウトカム(PRO)を中心に」という講演をいただきました。
医薬品関連ニュースで聞くPMDA、FDAって?
新薬は研究、開発のあと、審査・承認を受けて販売できますが、この審査・承認を行う機関は国や地域で別々に設置されており、代表的なものとして以下の機関があります。
日本:独立行政法人 医薬品医療機器総合機構(PMDA、厚生労働省所管)
アメリカ:Food and Drug Administration(FDA)
EU:European Medicines Agency(EMA)
新薬開発にあたって、この機関の名前を耳にすることが多くなると思います。是非覚えておきましょう。
「治療薬を開発したい!だけど・・・」様々な壁を超えていくために
開発者は、患者の治療薬を開発したい、との思いで日々の研究開発に努めていますが、病気についてわからないことも多く、どのような臨床試験を行えば良いかわからない、といった悩みがあります。この壁を超えるために、自然歴研究(観察研究)や患者報告アウトカム※の収集、を行うことがあります。
※アウトカム:何かの物事・情報から発生した結果を元に得られる成果・効果
自然歴研究とは何か
○どんな研究なのか?
疾患が発症してから、治療を行わない(合併症の治療ではなく、根本治療薬が投与されていない)状態における、疾患の経過を観察する研究です。
○どのように役立つのか?
1.開発薬の対象となる患者を特定
- 病気に関する因子(遺伝子など)について解明できる
- どのような患者に、開発中の治療薬が効くか予測できる
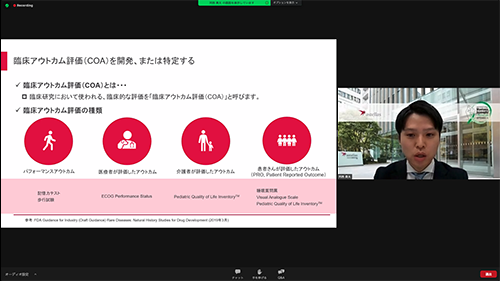
2.臨床アウトカム評価の開発
臨床研究において使われる、臨床的な評価のことであり、以下の4つがあります。
- パフォーマンスアウトカム:記憶力試験や歩行試験の評価
- 医療者が評価したアウトカム:質問票などを使って、医療者が疾患の状態を評価
- 介護者が評価したアウトカム:質問票などを使って、小さい子供のことを両親が評価、など
- 患者が評価したアウトカム(PRO): 質問票などを使って、患者自身が評価
このように、複数のアウトカム評価がありますが、疾患の進行度合いや改善度合いをしるために、どの評価法が適切なのかは、研究を行わないとわかりません。これを調べるために自然歴研究を行うことがあります。
3.バイオマーカーの開発
前述のとおり、バイオマーカーとは「血液や尿、唾液等から遺伝子などの変化を調べることによってわかる客観的な指標」のことです。例えば、ある遺伝子が有る人は調子が悪そうだ、であるとか、この遺伝子が無い人は元気そうだ、ということがわかれば、この遺伝子をバイオマーカーとして、治療効果を予測できる可能性があります。
4.対照群として、データを活用
一般に、新薬開発では治験薬の効果や安全性を比較する際、対照群(有効成分が入っていない薬との比較)が必要になります。しかし、希少疾患では患者が少なく、対照群の設定が難しい場合があります。このような疾患において、自然歴のデータを対照群のデータとして利用できる可能性があります。
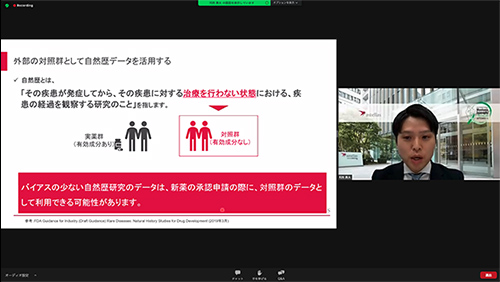
このように自然歴研究の結果は、上記のように活用された場合、治療薬開発を早めることができる可能性があります。
注目されているアウトカム評価「患者報告アウトカム(PRO)」とは
患者報告アウトカム(PRO)は、患者自身が直接、新薬の有効性、安全性、有用性を評価するという考え方で、従来のアウトカムに加えて評価することで、医療に提供できる情報の幅が広がるものであり、今、製薬企業等で注目されています。
実際、平成22~26年の5年間において、日本で承認された医薬品のうち、約12%において、主要評価項目にPROが用いられています。
また、FDAやEMAにおいても、PROの考え方や開発方法について、複数のガイドラインが制定されています。日本でも、本年9月7日にPMDAにより発出された患者参画ガイダンスのなかで、PROを評価項目の一部とした承認申請の増加が想定され、有用なツールである、ということが記載されています。
さらに、スマートフォンなどの普及により、デジタルツールを用いたPROデータの取得が進むことも予想されます。
やはり「患者の協力なくして、治療薬の開発はなし」
先の東山様の説明にもありましたが、希少疾患で医薬品開発を行うには、まず、疾患に対する理解が大切になります。
そのために、自然歴研究や患者報告アウトカムの収集が重要になります。患者にも、いや、患者にしか出来ないことがあります。皆が理解し、協力して、この病気の未来を変えていきましょう。
患者が参加できる2種類の観察研究のご紹介
続いて、社会医療法人石川記念会 HITO病院に勤務する内科医で、患者でもある、当患者会の副理事長の明地 雄司から、筋強直性ジストロフィー患者が参画できる研究が紹介されました。
自身の病気の研究に参加するメリットは、ずばり、「治せる病気にすること」と「医療を進歩させられること」です。
同じ病気の他の患者を救うためにも。同じ病気の子供を治療するためにも。自身のためにも。Remudyへの患者登録はもちろんですが、加えて、詳細な検査により、病気の進行について早期発見・対応ができることで、予後のQoL向上に大きく貢献することでしょう。是非、勇気をもってご参加ください。
筋強直性ジストロフィーの自然歴研究とバイオマーカー探索
筋強直性ジストロフィーに対する非侵襲性人工呼吸療法の効果に関する多施設共同研究
<最後に>
すべてのご講演終了後に寄せられた質問について、アステラス製薬の皆様から、そのひとつひとつに非常に丁寧にお答えいただきました。
前回に引き続き、このような貴重な機会をくださったアステラス製薬のみなさまに、あらためて感謝を申し上げます。ありがとうございました。
当会は引き続き、医学研究・臨床試験における患者・市民参画(PPI:Patient and Public Involvement)の取り組みを促進してまいります。



