治療薬情報が読み解けるようになる!:ウェビナー「わかる遺伝子と治療薬」レポート
2021年7月24日(土)、DM‐family主催のウェビナー「わかる遺伝子と治療薬」を開催、約70名が聴講しました。
7月最終週の土曜日は「国際筋強直性ジストロフィー家族の日(International Myotonic Dystrophy Family Day)」です。イギリスのCure DMを主宰されているアシュレーご夫婦の発案で、患者と家族が集まる日として始まりました。
この日に合わせて開催した今回のウェビナーでは、東京大学名誉教授 石浦章一先生から「わかる遺伝子と治療薬」というテーマで、すべての筋ジストロフィー患者と家族、医療従事者に向けて、基本から最新のことまでわかりやすく、お話しいただきました。

東京大学名誉教授 石浦章一先生
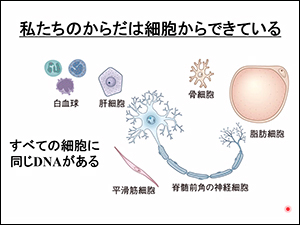
身体の構成:身体>細胞>遺伝子>DNA→mRNA→タンパク質
わたしたちの体は細胞からできています。細胞の核の中には、「染色体」があり、それをほどいてみると、DNAが現れます。このDNAの一部(全体の2%)が「遺伝子」と呼ばれるものです。
DNAはアデニン(A)、チミン(T)、グアニン(G)、シトシン(C)という4つの塩基からできています。
A―T、G―Cはそれぞれ対をなして二重らせん構造となっています。一つの核には30億の塩基対が入っています。
遺伝子が刻まれている部分のDNAの情報を写し取って、メッセンジャーRNA(mRNA、メッセンジャー・アールエヌエーと読みます)が作られます。
mRNAはアデニン(A)、ウラシル(U)、グアニン(G)、シトシン(C)で作られます。DNAと主な違いは、TがUになっていることです。
そしてmRNAを元にして、タンパク質が作られます。
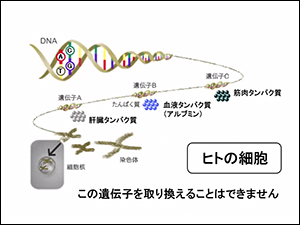
細胞の中にある遺伝子は取り替えることはできません。

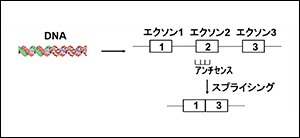
「スプライシング」とは?
「スプライシング」は筋強直性ジストロフィーの治療法を読み解くために大事な言葉です。
遺伝子は、体に必要な「タンパク質」を作るための設計図です。「エクソン(下図のグレー部分)」という設計図が入っている部分を「イントロン(線で表している部分)」でつないでいます。
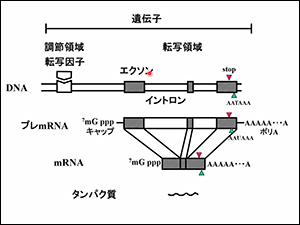
エクソンの組み合わせにより、複数のmRNAが作られます。
スプライシングとは、エクソンを切り取ることを言い、必要な選択をして切り取ることを選択的スプライシングと言います。
そして、このmRNAからタンパク質が作られます。
DNAからmRNAを作ることを「転写」と言い、mRNAからタンパク質を作ることを「翻訳」と言います。
細胞すべてに同じDNAがありますが、細胞の種類や部位によって、それぞれに必要な「選択的スプライシング」が行われています。(注:厳密にはもっと複雑なことがかかわっています)
筋強直性ジストロフィーは、このスプライシングが異常になることで様々な症状が起こると考えられています。
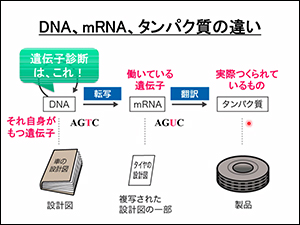
図の例では、以下のようになります。
- DNA=ヒトの体全部の設計図
- mRNA=複写された設計図の一部(働いているもの)
- タンパク質=製品
筋強直性ジストロフィーの原因は
筋強直性ジストロフィーは第19染色体のDMPK遺伝子の末端でDNAの塩基(C・T・G)の繰り返しが異常に伸びていることが原因です。(DM-familyサイト「治療法開発」でも解説しています)。
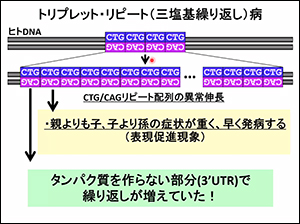
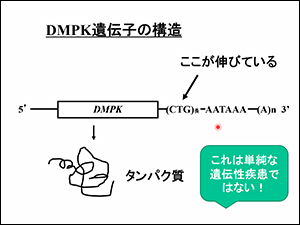
「遺伝子の末端が伸びているのに、なぜ病気になるのか?」という大きな疑問があり、そのメカニズムが解明され、治療法が発案されるようになってきました。
DMPK遺伝子が何をしているかは、わかっていないが・・・
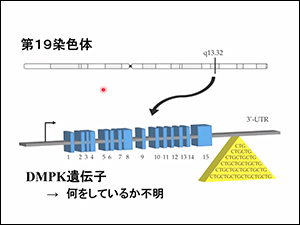
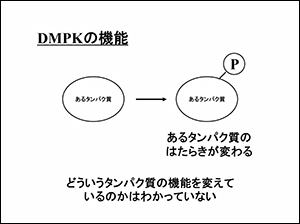
DMPK遺伝子が何をしているのか?実は、ある別のタンパク質にリンを付ける機能(キナーゼ、と言います)があります。
リンを付けるとタンパク質の働きが変わります(リン酸化)が、今も、DMPK遺伝子がどういうタンパク質の機能を変えているかはわかっていません。
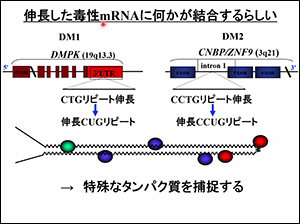
CTGの繰り返しが長いと、なぜ病気になるのかは、わかってきた
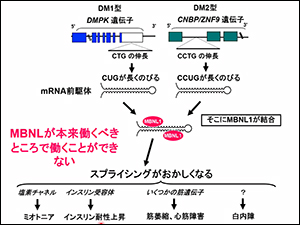
DNAの最後の部分にあるCTGの繰り返しが伸びることで、mRNAも一緒に変わります。
伸びているmRNAに何かが結合しているらしい。それが、スプライシングを調節する因子MBNL(muscleblind-like)ということがわかりました。
スプライシングがうまく調節できないので、余計なものができて、必要なものができません。
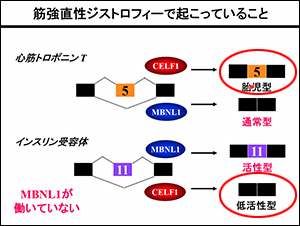
たとえば、心臓の病気(心筋トロポニンT)では必要のないエクソンを付けてしまうことが原因であり、インスリン受容体では必要なエクソンが付かないままになっています。
いずれもMBNLが正常に働かないことで起きています。
MBNLは1~3の3種類がありますが、石浦先生のご研究成果で、3種類は似ていることがわかり、MBNL1だけを考えればよいとわかりました。
筋強直性ジストロフィーは、MBNL1が働いていないことが問題です。
MBNL1はなせ働かない?
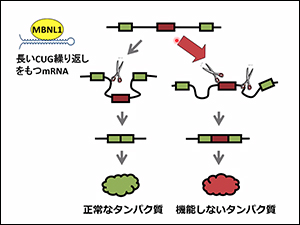
例えば、図の中でグリーンのエクソンだけをつなぎたい場合、MBNL1が働いてグリーンだけをつなぎ、正常なタンパク質になります。しかしMBNL1が働かないと余計なエクソンがついて、機能しないタンパク質になります。
MBNL1は伸びているmRNAにくっついているため、機能していません。
全身でいろいろな遺伝子がスプライシング異常を起こすので、全身に症状が出てしまいます。
治療法はMBNLを正常に働かせること
MBNL1を正常に働かせるための治療法は、主に3つの方向性があります。
1.長いリピートRNAを分解する
2.スプライシングを変える
3.MBNL1を働かせる(リピートから外す、増量する)
このうち、「MBNL1を働かせる」治療法は、大阪大学 中森雅之准教授が現在、治験第2相を行っています。
https://rctportal.niph.go.jp/detail/jr?trial_id=jRCT2051190069
治療のカギとなる「アンチセンス」は、悪いmRNAを分解する方法
「アンチセンス(アンチセンスオリゴヌクレオチド)」は核酸医薬とも言われており、スプライシングを変えたり、悪いmRNAを分解したりすることに利用できます。
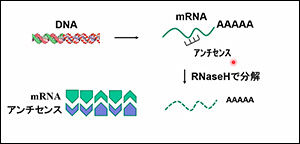
アンチセンスとは、悪いmRNAに鍵と鍵穴のようにぴったり付くDNAです。
mRNAは、DNAのように二本鎖ではなく、一本鎖です。 アンチセンスを付けると、悪いmRNA部分のみが二本鎖になるので、こうした部分だけをヒトの体が持っている「RNase H(Ribonuclease H)」が分解することで悪いmRNAがなくなり、スプライシングが正常化します。
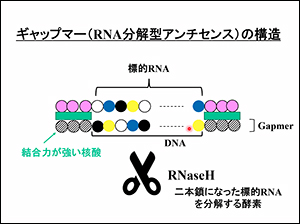
また、ギャップマー(RNA分解型アンチセンス)は、悪いRNAの端に結合力の強い核酸を付けておき、悪いRNAにアンチセンスを貼り付けて分解する方法で、効率の良いアンチセンスと言われています。
アンチセンスは、上記のほかにスプライシングを変化させることもできます。この方法はデュシェンヌ型筋ジストロフィーの治療薬「ビルテプソ」で使われています。
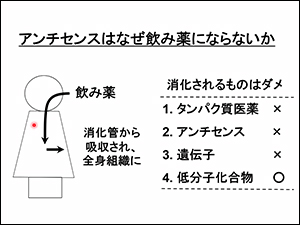
アンチセンスが飲み薬にならない理由
筋強直性ジストロフィーの治療薬は、全身の細胞にある核に届かなくては効果がありません。しかし、アンチセンスは胃の中で消化されてしまうため、飲み薬にはなりません。
全身にアンチセンスを届かせるためには
飲み薬にならないアンチセンスを、全身の細胞核に行き渡らせるためには、まずは静脈注射が必要です。
しかし、静脈注射だけでは血管の中にしか入りません。臓器に入り、細胞に入り、核に入らなければ悪いmRNAにたどり着きません。
現在、さまざまな製薬企業や研究者がどのようにアンチセンスを全身の細胞核に行き届かせるかを研究しています。
参加者からのアンケート:もっと学ばなくては!
ウェビナー終了後、参加者からのアンケート回答は、「いままでよくわかっていなかった遺伝子の知識がよくわかった」という声が相次ぎました。
「今までの私はただ単に新薬の早期承認を願うばかりでしたが、病気の原因、遺伝子の異常について詳しく知ることができました。まだまだ勉強不足だと痛感しました。」といった回答も見られました。
今回のウェビナーでは、石浦先生からDM-familyにご寄贈いただいた書籍2冊・50セットを、希望者に抽選で贈呈しました。あらためてお礼を申し上げるとともに、書籍の紹介をさせていただきます。
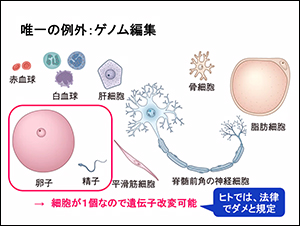
コラム:体内の細胞を取り替える唯一の例外「ゲノム編集」とは
ウェビナーの冒頭で、全身にあるヒトの遺伝子を変えることはできない、とされていましたが、唯一の例外は「ゲノム編集」という話も示されました。
精子と卵子は細胞が1個なので、それを編集すれば子どもは遺伝病を発症しません。
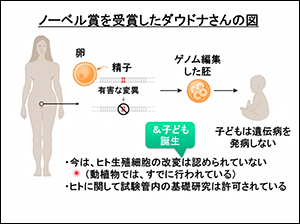
2020年にノーベル化学賞を受賞したジェニファー・ダウドナさんは、Nature誌で「5年~10年後には可能になるだろう」と予測していますが、石浦先生からは「ドナーに許可を取る必要、将来の意味ある臨床応用が見込まれること、倫理問題をクリアする必要、透明性のある対応が必要」と、わたしたちに問題提起をされました。
病気を治すとはどんなことなのか、わたしたち患者と家族は考えて行く必要があります。