治療法への道は「自分を知る」ことから:ウェビナー「患者に必要な治療薬開発の知識とは」レポート
2022年9月11日(日)、2020年度・2021年度に引き続き、アステラス製薬株式会社様のご協力により、ウェビナー「患者に必要な治療薬開発の知識とは」を開催し、約100名の参加者が聴講しました。
なお、本ウェビナーは昨年と同様、9月15日の「国際筋強直性ジストロフィー啓発の日」を記念して実施致しました。

「医師に知ってもらうこと」と「臨床試験への準備をすること」
開会のごあいさつとして、アステラス製薬株式会社 ペイシェント・セントリシティ室 東山 浩之様から、「わかりやすく、楽しく学べるセミナーにしたい」との意気込みをお聞かせいただいた後、当患者会の妹尾みどり事務局長から、「国際筋強直性ジストロフィー啓発の日 その目指すところ」について説明致しました。
医療者が本疾患を十分に知らないことは、患者や家族にとっての不利益に繋がります。知ってもらえれば、定期的な検診を通して、早期対応が可能な症状も多くあります。
まずは、自分が困っていることを医師にしっかり話しましょう。
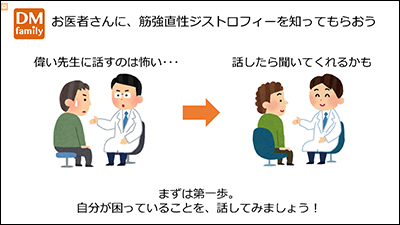
臨床試験へのお誘いがあった際、みなさんはご自身で参加を判断できますか?参加を決めるのは患者自身です。医師や家族ではありません。その時に向けて、臨床試験の説明文を十分に理解できるように勉強し、準備しておくことも大切です。

はじめのご講演は、アステラス製薬株式会社 開発本部メディカルスペシャリティズ 木村 円様から「原因と治療の理解のために、遺伝子のお話し」と題してお話し頂きました。
木村様は神経内科専門医として、また、研究者として、豊富なご経験をお持ちであり、国立精神・神経医療研究センター在職中は、筋ジストロフィーの患者登録「Remudy」の運営を担当されていました。
「製薬企業が製造販売承認の認可を受けて薬を作らないと、患者に薬を届けることはできない。そのために自身が製薬企業に飛び込み加速したい。」その思いから、現在はアステラス製薬株式会社にて開発に取り組まれています。

「遺伝」と「遺伝子」。違い、わかりますか?
人の体は常に健康な状態に戻ろうとします。この状態がうまくいかなくなると病気になります。
人の体にある遺伝子が原因で、病気になることもあります。
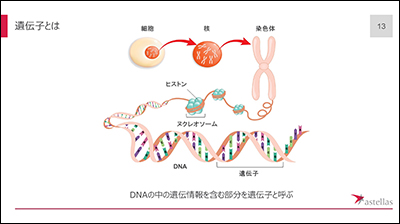
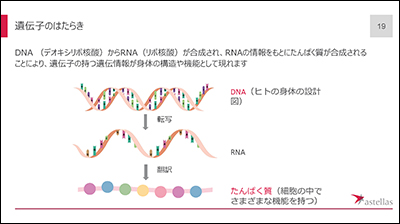
ところで「遺伝子」とは何でしょう?細胞のなかにある染色体を紐解いていくと、DNA(デオキシリボ核酸)が巻き付いたヌクレオソームがあり、そのDNA上の遺伝情報を含んだ部分を遺伝子と呼びます。DNAからRNAが転写され、RNAからタンパク質が合成されますが、遺伝子に変異(異常)があると、正常なタンパク質は合成されず、体の機能が失われます。
筋ジストロフィーのタイプにより、原因はさまざま
遺伝子の異常が原因で起こる疾患には、1つの遺伝子が原因となる「単一遺伝子疾患」や、複数の遺伝子が原因となる「多遺伝子疾患」があります。また、ガンなどのように、遺伝子の突然変異で起こる疾患もあります。
東京大学名誉教授 石浦章一先生のご厚意で先生のスライドをお借りして説明します。筋ジストロフィーは単一遺伝子疾患であり、さまざまな型がありますが、例えば、mRNAの異常伸長が原因となる筋強直性ジストロフィーや、タンパク質ができない、もしくは不完全なタンパク質が出来ることが原因となるデュシェンヌ型筋強直性ジストロフィー(DMD)、ベッカー型筋強直性ジストロフィー(BMD)があります。DMDの原因の60-70%は遺伝子の欠失によるものであることがわかっています。
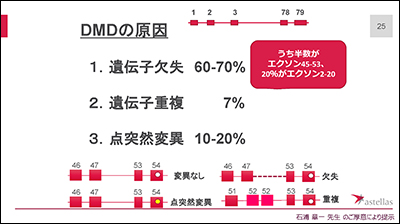
DMD、BMDでは筋肉中のジストロフィンというタンパク質が無くなること、もしくは、働きが弱ることで起こります。DMDでは、細胞内でのジストロフィンの合成が途中で止まってしまい、BMDでは、間が抜けたりして小さいものが出来ます。これにより両型で症状が異なってきます。
病気の原因を知ることが治療法開発の第一歩
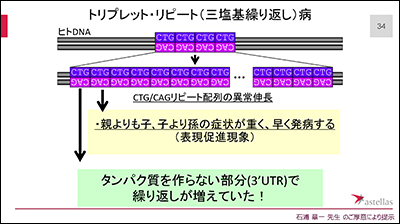
筋強直性ジストロフィーは、原因遺伝子の一部分(C・T・Gの部分)が異常に長くなることにより、各種症状が引き起こされます。これまでの研究により、このC・T・Gの繰り返しは、世代を経るごとに長くなり、それに対応するように早く発病したり、症状が重くなったりします。よって、このC・T・Gの繰り返し部分をターゲット(目標)として治療法の開発を行います。
多くの筋ジストロフィーと関連疾患において、原因となる遺伝子は判明していますが、実は、原因がわかっていない病気もとても多いのです。このような病気の原因となる遺伝子を調べる研究は大変重要であり、遺伝子解析技術の進歩により、この10年間、世界中で急速に今までは診断がつかなかった病気の原因が解明されています。新しい希少疾患が発見・診断され、原因遺伝子が発見されるようになってくると、希少疾患の治療薬の開発も増えてきます。
遺伝子治療とは?
「治療」とは、病気をよくするための医療行為です。遺伝子治療は、主に注射により行います。
https://www.nihs.go.jp/mtgt/pdf/2019-PharmaTechJapan,35,2533-45.pdf
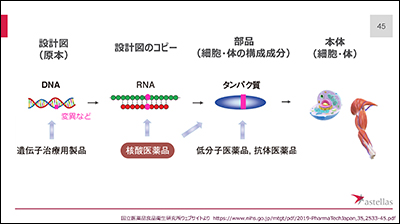
①DNAに変異があると、
②その変異を受けたRNAが生成され、
③異常なタンパク質が出来ます。
大まかにいうと、①に対応するのが遺伝子治療用製品、②が核酸医薬品、③が低分子医薬品等になります。
核酸医薬品とは、DNAやRNAに似た形(構造)のもので、特定の配列のDNAやRNAにくっついたり、特定のタンパク質にくっついたりする性質があります。筋ジストロフィーの分野では、スプライシングの制御に関わる、アンチセンス等の核酸医薬が注目されており、日本でも脊髄性筋萎縮症(SMA)で核酸医薬は承認、市販されていますが、多くは開発中です。
さて、遺伝子治療とはどんな治療なのでしょうか。その答えの1つは
「遺伝子を用いて、病気の原因に直接働きかける治療」
です。
具体的には、細胞に遺伝子を入れ、そこで足りないタンパク質を作る治療のことをいいます。その手法として、ウィルスベクター(細胞への運び屋)を使います。
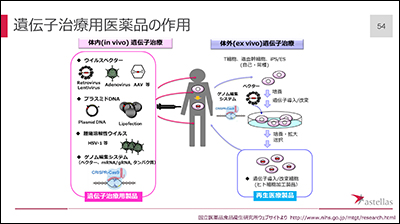
手法は2つに分けることができます。
体内(in vivo)遺伝子治療
遺伝子を乗せたベクター等を患者に直接投与する
体外(ex vivo)遺伝子治療
人の体から取った細胞に治療遺伝子を入れ、治療した細胞を患者に戻す
いまのところ、アデノ随伴ウィルス(AAV)を使った体内遺伝子治療が一番臨床に近いものです。
https://www.nihs.go.jp/mtgt/research.html
導入遺伝子として何を運ぶのか、これがポイントになります。AAVを用いて、欠損する遺伝子を入れ、正常なタンパク質が合成されるようにする「遺伝子置換」がメインですが、本来の機能を示すよう修復(エクソンスキッピング)したり、異常なRNAやタンパク質を除去(RNAノックダウン)したりする「遺伝子調節」を示す作用物質を用いる研究も進んでいます。
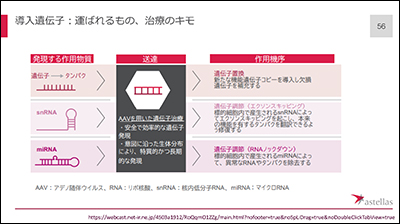
遺伝子治療の投与方法としては、局所注射で直接筋肉に入れる場合と、点滴で全身の細胞に運ぶ方法があります。
遺伝子治療の課題
とても希望の持てる遺伝子治療ですが、以下のポイントを理解しておかねばなりません。
✔全世界で実施される遺伝子治療の臨床試験はその多くがアメリカで実施されていること
✔実施されている臨床試験は、多くがガンを対象としたものであること
✔全身の筋肉を治療しようとすると、目の治療に必要な薬剤の約1万倍の投与量が必要であること
→安定して薬を作れる体制が必要(とはいえ、高投与量が必要となる神経筋疾患を対象とする治療薬開発も進んでいます)
✔AAVベクター遺伝子治療は、開発中において、肝臓毒性や神経毒性などが確認されていることも多いこと
→有害事象には厳重な注意が必要です。
このような大きなハードルを少しずつ超えながら開発は進んでいます。
※木村円様のご講演内容は、アステラス製薬株式会社株式会社様の公式の意見ではございません。
治験と治療はどう違う?
続いて、アステラス製薬株式会社 開発本部プロジェクト推進部 高橋 秀之様から「治験と治療はどう違う?」と題し、ご講演頂きました。

「治験」は新薬の最終試験
薬の候補は開発の最終段階においては、人での効果と安全性を確認します。この成績を国が審査、承認して、新しい薬として処方できるようになります。
人における試験を臨床試験といい、国の承認を得るための臨床試験を治験といいます。
治験は要件を満たす病院でのみ実施されます。
治験参加者の人権を最優先に。治験のルール「GCP」
治験を行う製薬会社、病院、医師は「薬機法」という法律と、GCP(Good Clinical Practice)という規則を守る必要があります。GCPの内容は主に以下のとおりです。
〇治験の内容を国に届けること
「治験実施計画書」(「くすりの候補」の服薬量、回数、検査内容等)を厚生労働省に届け出ます。
〇治験内容を事前に審査すること
治験検査委員会で審査。治験者の人権と福祉が守られているか。科学的な内容か、など。
治験を実施する病院は、委員会からの指示に従わないといけない。
〇同意を得られた患者のみを治験に参加させること
目的、方法、期待される効果、予測される副作用等を文書で説明し、同意が必要。
〇重大な副作用は国に報告すること
重大な副作用は国に報告され、患者の安全確保のため、必要に応じて計画を見直す。
〇治験が適正に行われていることを確認すること
治験を依頼した製薬会社の担当者(モニター)は、「治験実施計画書」やGCPの規則を守って適正に行われていることを確認します。
治験は参加希望するだけでは受けられない
治験には参加条件があります。患者が参加を希望しても、条件を満たさない場合は治験に参加することができません。その可否は治験を担当する医師が行います。
インフォームド・コンセント ~説明と同意~
治験への参加は医師から尋ねます。治験は患者の意思によるものでないと実施できません。この説明と同意をインフォームド・コンセントといいます。
医師からは、治験の目的、方法をはじめ、治験参加はいつでも止められること、などが記された「説明文書」を用いて詳しく説明いただきます。この際、わからないことなどは納得するまで質問できます。また、プライバシーは厳重に守られます。
なお、治験中は安全性に対して最も注意が払われます。また、治験中は患者負担を少なくする配慮が取られます。(例:治験相談窓口の設置、検査費用とくすりの費用負担、通院の交通費など)
治験を進めるために患者ができること
薬の開発を進めるためには、患者の治験参加が必要です。特に希少疾患でのレジストリ(患者登録)は重要であり、多くの患者さんが登録されているレジストリは、くすりの開発に寄与することが期待されます。
また、開発計画を考える際に、自然歴(自然の状態で症状がどのように推移するか)の情報が重要で、特に希少疾患のレジストリから得られる自然歴の情報は、不足している場合が多いため、大変重要です。
治験に関する情報
当日の講演で示された参考情報は下記となります。
○製薬協HP の「治験とは」
https://www.jpma.or.jp/about_medicine/shinyaku/tiken/base/chiken/index.html
○製薬協HP 「新しい薬を誕生させるために」
https://www.jpma.or.jp/about_medicine/shinyaku/tiken/base/chiken/lofurc0000003s8p-att/kusuri_081.pdf
○製薬協HP「くすりと治験」
https://www.jpma.or.jp/about_medicine/shinyaku/tiken/base/chiken/lofurc0000003s8p-att/chiken_081.pdf
○製薬協HP の「くすりと治験について学ぼう!(音声説明)」
https://www.jpma.or.jp/information/evaluation/results/allotment/chiken_081_description.html
○厚生労働省HP の「治験ついて(一般の方へ)」
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/fukyu.html
筋強直性ジストロフィーを対象としたレジストリ、自然歴研究の情報
○神経・筋疾患患者登録サイトRemudy
○筋強直性ジストロフィーの自然歴研究とバイオマーカー探索
質疑応答
本稿では、当日にあった質問と回答の一部を紹介致します。
-
現在承認されている核酸医薬のなかで、筋強直性ジストロフィーの治療薬はありますか?
-
残念ながら今のところはないです。ただ、アメリカをはじめ、さまざまなところで開発が進んでいます。
-
遺伝子治療をはじめとする治療法の開発を日本で推進するために、患者や患者の家族ができることはありますか?
-
患者や家族は患者会に入るなどして、団体として力を持ち、専門家も交えながら、自分たちの治療薬を手に得るためにはどんなことをしたら良いのか、ということをみんなで考えていくスタイルを持っていくべきです。
一人ひとりの患者がそういう考えを持つようにしていただきたいです。(アステラス製薬株式会社 木村 円様)
アンケートから
終了後に寄せられたアンケートでは、多く方から「治療薬の開発が急速に進んでいる事を知り、希望が持てた」「治療薬開発にあたって、疾患への理解が重要だとわかった」などの声をいただきました。
また、「患者や関係者が治療薬を欲しいという意思を示していくべきだと強く感じた」「考えても治らないと投げやりの10年だった。今後もっと知っていきたい」など声があり、新たな思いが芽生えた方も多かったようです。
治療薬開発の促進には、高橋様のご講演でもありましたように、患者登録と自然歴情報が重要です。患者にもできることがあります。
ご回答いただいたみなさま、アステラス製薬株式会社の講師の皆様に、改めてお礼を申し上げます。
ありがとうございました。